Știați despre reacția sfântă a graalului în chimie?
April 22, 2024
Când vine vorba de gaze naturale, nu trebuie să fiți necunoscut cu acesta, iar în zilele noastre nici o gospodărie nu poate găti fără ea. Componenta principală a gazelor naturale este metanul, care este unul dintre cei mai simpli compuși hidrocarburi. Accelerarea dezvoltării și utilizării metanului este cheia realizării dezvoltării ecologice și durabile a industriei energetice și chimice. În plus față de utilizarea sa directă ca combustibil, metanul poate fi folosit și ca resursă C1, adică o moleculă care conține un atom de carbon și poate continua să fie convertită pentru a pregăti substanțe chimice adăugate cu valoare ridicată, cum ar fi metanol, formic, formic acid și așa mai departe. Metanul poate fi ars în oxigen pentru a forma apă și dioxid de carbon. Fără combustie, este posibil să se activeze și să se transforme legăturile de hidrocarburi ale moleculelor de metan în condiții ușoare? Raspunsul este da! Aceasta este reacția „Sfântul Graal” în câmpul catalizei. Reacțiile asociate cu „graalul sfânt” sunt adesea extrem de provocatoare, deoarece ar putea fi nevoie să fie efectuate în condiții foarte dure sau ar putea fi nevoie să depășească dificultățile inerente ale unei reacții chimice, cum ar fi activarea compușilor extrem de stabili, scăzute randamente și selectivitate scăzută. Aceste provocări îngreunează realizarea acestor reacții, dar dacă pot fi obținute cu succes, acestea vor duce la descoperiri semnificative în cercetarea științifică și aplicațiile industriale.

1. Calgele în conversia metanului la temperaturi scăzute Este foarte dificil să convertiți metanul direct în alte substanțe chimice utile cu oxigen ieftin la temperaturi scăzute sau chiar la temperatura camerei, de ce este asta? Să ne uităm la natura metanului și a oxigenului. Structura chimică a metanului conține patru legături identice de carbon-hidrogen (CH) care formează o configurație ortotetraedrică extrem de simetrică și fiecare legătură CH3-H de metan are o energie de legătură de până la 435 kJ/mol. Ne putem gândi la legătura CH a metanului ca la un izvor deosebit de puternic. Primăvara în această primăvară este foarte tăiată și necesită multă forță pentru a se întinde. În chimie, această „forță” este energia necesară pentru ruperea legăturii CH. Această energie de legătură ridicată face ca legăturile CH ale metanului să fie termodinamic stabile și foarte dificil de descompus sau de reacție cu condiții normale. On the other hand, in chemical reactions, reactive groups are usually generated under polar interaction (polar interaction is the phenomenon that a molecule has one end positively charged and the other negatively charged), whereas the symmetric structure and nonpolar nature of the methane molecule prevents De la generarea unei astfel de polaritate (în funcție de configurația moleculară, o moleculă cu un plan de simetrie nu are polaritate) și nu poate oferi grupuri reactive. Prin urmare, activarea și conversia metanului este foarte dificilă și, de obicei, necesită condiții dure, cum ar fi temperaturi ridicate (600-1100 ° C) sau unele „extremfilici”, cum ar fi acizii super-puternici și radicalii liberi pentru a ajuta la activarea metanului. Prin urmare, principala dificultate în realizarea activării la temperaturi scăzute a metanului și oxigenului constă în modul de activare a legăturii CH a metanului, adică cum să întinzi „arcul” în legătura CH. 2. Minunea catalizatorului Oamenii de știință au venit cu o soluție bună la această problemă și au ales să folosească un catalizator pentru a ajuta la activarea metanului la temperaturi scăzute (un catalizator este un produs chimic care nu se schimbă înainte sau după o reacție, dar accelerează reacția prin modificarea cantității minime de energie care trebuie injectată pentru ca reacția să aibă loc). În 2023, jurnalul Nature Catalysis a raportat în procesul de realizare a conversiei directe a metanului cu oxigen în oxizi C1 (metanol (CH3OH), acid formic (HCOOH) și metilen glicol (HOCH2OH)) folosind un disulfură specific de molibden (MOS2) Catalizator la 25 ° C. O conversie de metan de 4,2% și aproape 100% oxigenate C1 au fost obținute prin transformarea metanului și oxigenului în oxigenatele valoroase C1 în condiții ambientale. Acest MOS2 este singurul catalizator raportat până acum, care poate realiza conversia temperaturii camerei a metanului și oxigenului. Acest lucru se datorează geometriei unice și structurii electronice a site -ului MO de la marginea MOS2. Acest loc MO are o activitate de activare ridicată către oxigen într -un mediu apos, formând speciile magice O = Mo = O*. Această specie face legătura de carbon-hidrogen mai ușor de rupt și reduce energia de activare a legăturii CH a metanului, crescând astfel foarte mult reactivitatea metanului și, astfel, realizând activarea la temperaturi scăzute a metanului și oxigenului. Această descoperire va aduce mai multe posibilități pentru utilizarea viitoare a energiei și protecția mediului, precum și ne va oferi o înțelegere mai profundă a rolului uimitor al catalizatorilor și auxiliarilor.
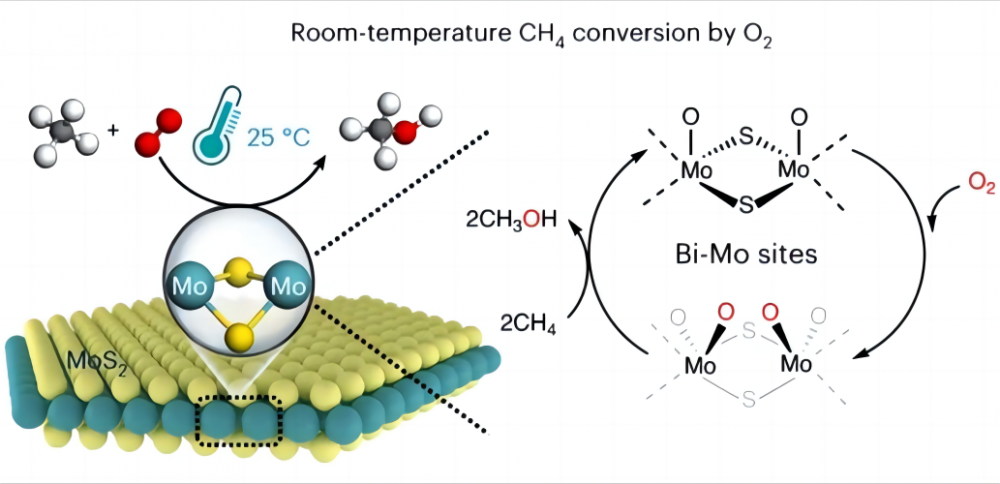
3. Semnificația strategică semnificativă a activării la temperatură scăzută a metanului Realizarea conversiei catalitice directe a metanului și oxigenului la temperatura camerei și transformarea metanului în gaze naturale în alte substanțe chimice utile, poate îmbunătăți mult rata de utilizare a gazelor naturale, reduce deșeurile și poate proteja mai bine mediul și să realizeze dezvoltarea durabilă a energiei . În al doilea rând, ca gaz cu efect de seră, metanul este al doilea doar la dioxidul de carbon în contribuția sa la încălzirea globală. Dacă metanul poate fi transformat în alte substanțe, ne poate ajuta să reducem emisiile de poluanți ai aerului (de exemplu, oxizi de carbon, oxizi de azot, oxizi de sulf, hidrocarburi și compuși eter) și ușurează presiunea încălzirii globale.




